Covid-19 : ce que les autopsies nous apprennent sur les caillots sanguins et embolies pulmonaires

Il s’agit de la première étude décrivant les résultats d’examens autopsiques complets réalisés sur une série de patients décédés de la maladie Covid-19. Publiée le 6 mai dans les Annals of Internal Medicine, elle a été menée par des légistes et anatomo-pathologistes du département de médecine légale du centre médical universitaire de Hambourg-Eppendorf (Allemagne). Les autopsies ont été complétées par la réalisation d’un scanner, une analyse microscopique de plusieurs organes (analyse histologique) et une évaluation de la charge virale dans divers tissus par la technique PCR.
Cette étude révèle la survenue fréquente de caillots sanguins dans les veines profondes et dans la circulation sanguine pulmonaire, autrement dit une fréquence élevée de maladie thromboembolique veineuse chez les patients Covid-19.
Malgré les progrès de l’imagerie (scanner thoracique, échocardiographie, IRM cardiaque, notamment), on sait peu de choses sur les causes de la mort des patients atteints de formes sévères ainsi que sur les lésions spécifiques associées. De fait, l’autopsie est d’une grande importance pour appréhender la nature précise de ces lésions et ainsi tenter de mieux comprendre les mécanismes physiopathologiques associés à cette nouvelle maladie virale.
Ces travaux, qui ont porté sur douze patients consécutifs morts du Covid-19, visaient à déterminer la cause du décès et à décrire les lésions.
Les autopsies ont été réalisées entre un à cinq jours après le décès des patients. Ceux-ci étaient en moyenne âgés de 73 ans (âge compris entre 52 et 87 ans). Neuf des 12 patients étaient des hommes. Deux patients sont morts en dehors de l’hôpital suite de l’échec de la réanimation cardiorespiratoire. Cinq autres sont décédés en unité de soins intensifs. Enfin, cinq patients sont morts alors qu’ils recevaient les meilleurs soins standards dans un autre service que celui des soins intensifs.
L’analyse histologique a porté sur les organes et tissus suivants : cœur, poumons, foie, reins, rate, pancréas, cerveau, prostate, testicules ou ovaires, intestin grêle, veine saphène (veine superficielle des membres inférieurs), artère carotide commune, pharynx, tissu musculaire. Quant aux examens virologiques, ils ont été effectués sur de petits prélèvements de cœur, poumon, foie, veine saphène et pharynx, ainsi qu’à partir d’échantillons de sang veineux.
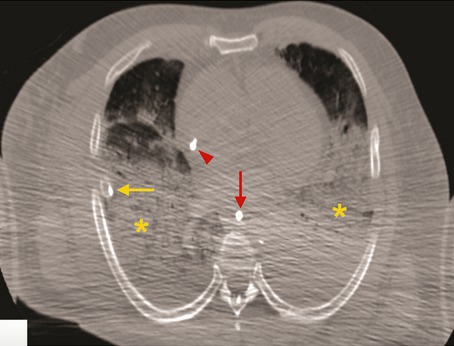
Le scanner thoracique a été réalisé sur dix des douze cadavres. Les corps ont été installés dans un sac avec une double épaisseur afin de protéger le personnel médical. L’imagerie a révélé dans les deux poumons la présence d’opacités diffuses (infiltrats réticulaires) ainsi que des anomalies sévères (condensations bilatérales), en l’absence de toute pathologie pulmonaire connue pré-existante.
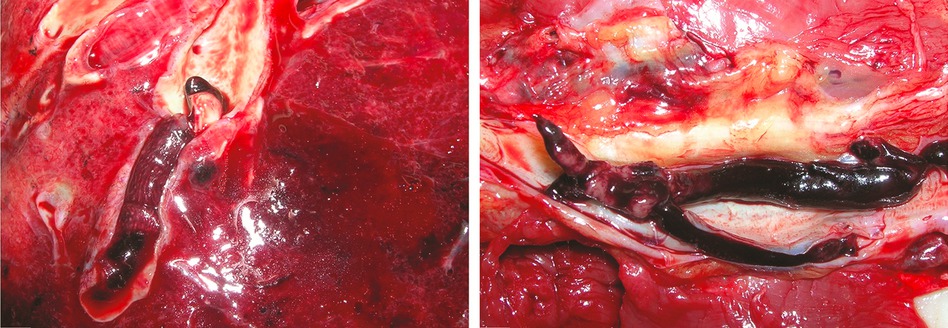
Embolie pulmonaire massive dans un tiers des cas
L’autopsie montre qu’une embolie pulmonaire massive a été la cause du décès dans quatre cas, un gros caillot (également appelé thrombus) ayant migré dans une branche de l’artère pulmonaire à partir d’une veine profonde des membres inférieurs. Dans trois autres cas, le patient était porteur d’une thrombose veineuse profonde mais en l’absence d’embolie pulmonaire. Les auteurs ont ainsi observé une fréquence élevée de thrombose veineuse profonde parmi les douze cas analysés. Par ailleurs, chez tous les patients ayant développé une thrombose veineuse profonde, les deux membres inférieurs étaient concernés.
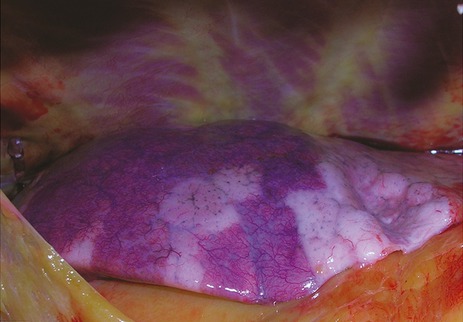
Des poumons à l’aspect extérieur impressionnant
Les poumons étaient souvent lourds, jusqu’à atteindre chez un patient un poids de 3420 grammes. Chez les patients autopsiés, le poids moyen du poumon était d’environ 1990 grammes, sachant que celui-ci est normalement environ 840 grammes chez l’homme et 640 grammes chez la femme.
La surface externe des poumons présentait un aspect bigarré avec des zones pâles alternant avec d’autres légèrement saillantes et fermes, très riches en capillaires et de couleur bleue-rougeâtre. « Ces modifications macroscopiques dans notre série autopsique sont impressionnantes et expliquent les difficultés à ventiler suffisamment la plupart de ces patients », déclarent Dominic Wichmann, Jan-Peter Sperhake et leurs collègues.
La consistance du tissu pulmonaire était ferme mais friable. Dans huit cas sur douze, ces modifications affectaient toutes les parties des poumons. L’aspect extérieur des autres organes était normal, à l’exception de la rate qui semblait touchée par l’infection virale chez trois patients.
Les médecins légistes indiquent avoir observé chez onze des douze patients des lésions liées à des pathologies cardiaques préexistantes : athérosclérose coronarienne, cicatrice myocardique indiquant une mauvaise oxygénation du cœur (cardiopathie ischémique), insuffisance cardiaque (cardiomyopathie congestive). Une tendance nette à l’obésité a été notée dans tous les cas sauf un patient atteint d’une tumeur neuroendocrine pulmonaire et présentant une maigreur extrême (cachexie).
Une atteinte alvéolaire diffuse dans la majorité des cas
« Dans les douze cas, la cause du décès résidait dans les poumons ou dans le système vasculaire pulmonaire », soulignent les auteurs. Plus précisément, l’examen histologique des poumons a montré une atteinte alvéolaire diffuse*, compatible dans huit cas avec un syndrome de détresse respiratoire aiguë (SDRA). Dans quatre cas, des signes évocateurs d’une infection bronchopulmonaire bactérienne associée ont été observés. Surtout, des micro-caillots (micro-thrombus) ont été détectés à l’examen microscopique du tissu pulmonaire dans quatre cas. Ces micro-thrombus ont été observés à l’intérieur de petites artères pulmonaires.
Des caillots ont également été trouvés dans les veines de la prostate, mais pas dans d’autres organes.
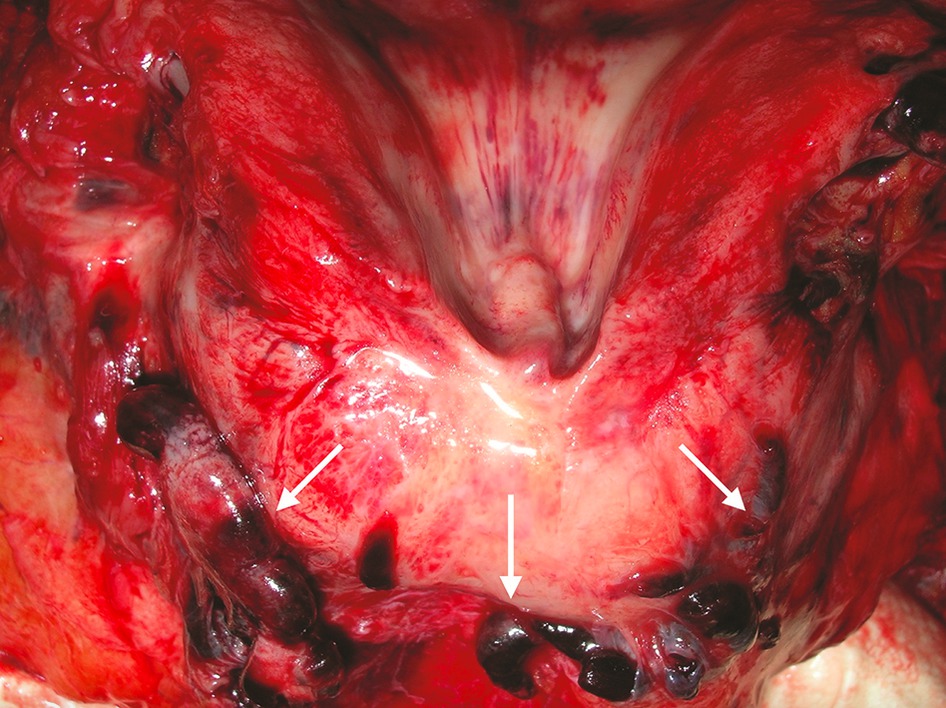
ARN viral dans le sang encore cinq jours après le décès
Les résultats de la PCR ont montré la présence de l’ARN viral dans les poumons des douze patients ainsi que dans le pharynx de neuf d’entre eux. La présence d’ARN viral dans le sang (virémie modérée inférieure à 4 × 104 copies/ml) a été détectée chez six patients. Parmi eux, l’ARN viral a également été trouvé dans d’autres tissus, en l’occurrence dans le cœur, le foie et les reins à des concentrations plus importantes que dans le sang. Chez quatre patients, l’ARN viral a été détecté dans le cerveau et la veine saphène. Ces résultats semblent indiquer que le SARS-CoV-2 pourrait diffuser via la circulation sanguine et infecter d’autres organes**.
A ce jour, on ne compte dans la littérature médicale internationale que trois autres publications rapportant les résultats d’autopsies complètes réalisées sur des patients Covid-19. Par ailleurs, quelques rares études ont été effectuées sur des prélèvements de tissu pulmonaire post-mortem chez de tels malades.
Cette étude autopsique confirme que la coagulopathie constitue une complication fréquente dans les formes sévères de Covid-19. De récents travaux ont en effet montré que l’atteinte pulmonaire observée dans l’infection par SARS-CoV-2 se caractérise par des thromboses microvasculaires (micro-thrombus) liées à une inflammation pulmonaire diffuse à laquelle s’associe un dysfonctionnement des cellules endothéliales qui bordent la paroi interne des vaisseaux et qui sont en contact direct du sang.
Coagulopathie intravasculaire pulmonaire diffuse
Des troubles de la coagulation associés à des phénomènes inflammatoires seraient donc au centre de l’atteinte pulmonaire. Il est également possible que la libération massive de molécules inflammatoires par les cellules immunitaires (« orage cytokinique ») soit responsable du déclenchement de l’activation directe de la « cascade de la coagulation », ensemble de réactions biochimiques aboutissant à la formation de caillots sanguins.
Enfin, la formation de caillots (thrombus) dans les poumons est favorisée par le faible taux d’oxygénation sanguine (hypoxémie) associé au syndrome de détresse respiratoire (SDRA) que l’on observe dans les formes sévères de Covid-19.
Plusieurs sociétés savantes, dont la Société Française d’Anesthésie et de Réanimation (SFAR), ont émis des recommandations concernant l’utilisation d’un traitement anticoagulant (héparine de bas poids moléculaire ou HPBM) pour la prévention du risque thrombotique chez les patients Covid-19 hospitalisés, couplée à la surveillance de l’hémostase (paramètres biologiques de la coagulation). Enfin, plusieurs pistes thérapeutiques sont à l’étude visant à lutter contre la coagulopathie chez les patients Covid-19, qu’il s’agisse d’agents bloquant l’action de l’interleukine-1, une cytokine pro-inflammatoire, ou de molécules ayant un effet immunomodulateur, susceptibles d’être efficaces contre les conséquences délétères des taux élevés de cytokines produites par les cellules immunitaires.
* A l’histologie, les lésions prédominantes concernent les pneumocytes activés (cellules bordant la paroi des alvéoles pulmonaires), la formation de membranes hyalines, la présence de thrombus microvasculaires, une congestion capillaire, un œdème interstitiel riche en protéines.
** La PCR quantitative ne permet pas de distinguer l’ARN viral génomique de l’ARN sous-génomique (fragments de moindre longueur). Pour démontrer l’existence d’une réplication du virus, il importe de détecter certaines molécules d’ARN dites intermédiaires, présentes lors du cycle viral réplicatif.
Pour en savoir plus :
Wichmann D, Sperhake JP, Lütgehetmann M, Steurer S, Edler C, Heinemann A, Heinrich F, Mushumba H, Kniep I, Schröder AS, Burdelski C, de Heer G, Nierhaus A, Frings D, Pfefferle S, Becker H, Bredereke-Wiedling H, de Weerth A, Paschen HR, Sheikhzadeh-Eggers S, Stang A, Schmiedel S, Bokemeyer C, Addo MM, Aepfelbacher M, Püschel K, Kluge S. Autopsy Findings and Venous Thromboembolism in Patients With COVID-19: A Prospective Cohort Study. Ann Intern Med. 2020 May 6. doi: 10.7326/M20-2003
Barton LM, Duval EJ, Stroberg E, Ghosh S, Mukhopadhyay S. COVID-19 Autopsies, Oklahoma, USA. Am J Clin Pathol. 2020 May 5;153(6):725-733. doi: 10.1093/ajcp/aqaa062
Copin MC, Parmentier E, Duburcq T, Poissy J, Mathieu D; Lille COVID-19 ICU and Anatomopathology Group. Time to consider histologic pattern of lung injury to treat critically ill patients with COVID-19 infection. Intensive Care Med. 2020 Apr 23. doi: 10.1007/s00134-020-06057-8
Fox SE, Akmatbekov A, Harbert JL, Li G, Brown JQ, Vander Heide RS. Pulmonary and cardiac pathology in Covid-19: the first autopsy series from New Orleans. medRxiv. Posted April 10, 2020. doi: 10.1101/2020.04.06.20050575
Hanley B, Lucas SB, Youd E, Swift B, Osborn M. Autopsy in suspected COVID-19 cases. J Clin Pathol. 2020 May;73(5):239-242. doi: 10.1136/jclinpath-2020-206522
McGonagle D, O’Donnell JS, Sharif K, Emery P, Bridgewood C. Immune mechanisms of pulmonary intravascular coagulopathy in COVID-19 pneumonia. Lancet Rheumatol. May 07, 2020. doi: 10.1016/S2665-9913(20)30121-1
Menter T, Haslbauer JD, Nienhold R, Savic S, Hopfer H, Deigendesch N, Frank S, Turek D, Willi N, Pargger H, Bassetti S, Leuppi JD, Cathomas G, Tolnay M, Mertz KD, Tzankov A. Post-mortem examination of COVID19 patients reveals diffuse alveolar damage with severe capillary congestion and variegated findings of lungs and other organs suggesting vascular dysfunction. Histopathology. 2020 May 4. doi: 10.1111/his.14134
Zhang H, Zhou P, Wei Y, Yue H, Wang Y, Hu M, Zhang S, Cao T, Yang C, Li M, Guo G, Chen X, Chen Y, Lei M, Liu H, Zhao J, Peng P, Wang CY, Du R. Histopathologic Changes and SARS-CoV-2 Immunostaining in the Lung of a Patient With COVID-19. Ann Intern Med. 2020 Mar 12. doi: 10.7326/M20-0533
Xu Z, Shi L, Wang Y, Zhang J, Huang L, Zhang C, Liu S, Zhao P, Liu H, Zhu L, Tai Y, Bai C, Gao T, Song J, Xia P, Dong J, Zhao J, Wang FS. Pathological findings of COVID-19 associated with acute respiratory distress syndrome. Lancet Respir Med. 2020 Apr;8(4):420-422. doi: 10.1016/S2213-2600(20)30076-X
